Az enzimek nélkülözhetetlenek a Föld összes élő szervezetének megfelelő működéséhez. Részt vesznek a legtöbb, ha nem az összes kémiai átalakulásban a természetben, vagyis a növények és az állatok világában is több millió reakcióban vesznek részt. Érdemes megtudni, hogy melyek az enzimek, hogyan működnek és mi a jelentőségük a modern orvostudomány szempontjából.
Tartalomjegyzék
- Enzimek: Szerkezet
- Az enzimaktivitás szabályozása
- Enzimek: Szerep
- Enzimek: Nómenklatúra
- Enzimek és gyógyszer
- A diszfunkcionális enzimekből eredő betegségek
- Enzimek: diagnosztikai felhasználás
- Enzimek és kezelés
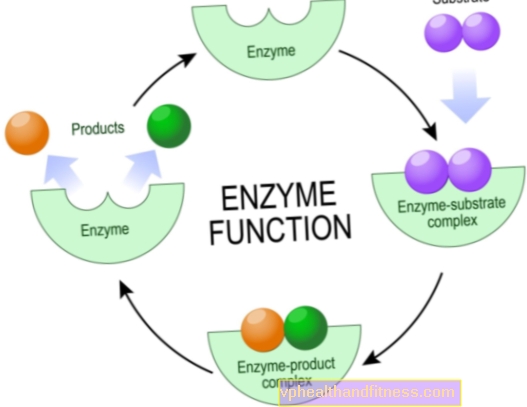
Az enzimek olyan fehérjemolekulák, amelyek felgyorsítják vagy akár megengedik, hogy különféle kémiai reakciók történjenek az élő organizmusokban, beleértve az emberi testet is.
Kémiai szempontból ezek katalizátorok, azaz részecskék, amelyek fokozzák a reakciót, de nem kopnak el a reakció során. A kémiai átalakítások hatékonyságának ez a növekedése gyakran hatalmas, a természetes katalizátorok rövidíthetik a reakcióidőt több évről több másodpercre.
Az enzimek a test minden területén megtalálhatók: a sejtekben, az extracelluláris térben, a szövetekben, a szervekben és azok fényében, amely az adott szövetet termeli, meghatározza annak sajátos tulajdonságait és a szervezetben betöltött szerepét.
A legtöbb enzim nagyon specifikus, ami azt jelenti, hogy mindegyikük csak egyetlen típusú kémiai reakcióért felelős, amelyben meghatározott részecskék - a szubsztrátok - vesznek részt, és csak ők léphetnek kölcsönhatásba egy adott enzimmel.
A természetes katalizátorok aktivitása sok tényezőtől függ: a reakciókörülettől, például hőmérséklettől, pH-tól, bizonyos ionok jelenlététől, aktivátoroktól - fokozzák az enzimek és inhibitorok hatását, amelyek ellensúlyozzák ezt a tevékenységet.
Enzimek: Szerkezet
Mint már említettük, a legtöbb enzim fehérje, nagyon változatos szerkezettel rendelkeznek: több tucat aminosavtól kezdve több ezerig, változatos térszerkezetben.
Kialakulásuk formája (az úgynevezett kvaterner szerkezet) és az a tény, hogy a legtöbb enzim sokkal nagyobb, mint a reakciójuk reagensei, nagyban felelős tevékenységükért.
Ez annak a ténynek köszönhető, hogy az enzimek szerkezetében csak egy bizonyos régió az úgynevezett aktív hely, vagyis a reakció végrehajtásáért felelős fragmens.
A molekula megmaradt fragmenseinek feladata egy meghatározott szubsztrát, ritkábban más, az enzim aktivitását befolyásoló vegyületek kötése.
Érdemes tudni, hogy a katalizátor szerkezetét úgy alakították ki, hogy az összekötő hordozó ideálisan illeszkedjen a "retesz kulcsához".
Mint minden fehérje, az enzimek is a riboszómákban termelődnek a magba szorosan bepakolt genetikai anyagból - a DNS-ből, ezáltal létrehozva egy úgynevezett elsődleges struktúrát.
Ezután többször hajtja végre - megváltoztatja alakját, néha cukrokat, fémionokat vagy zsírmaradványokat ad hozzá.
Mindezen folyamatok eredményeként egy aktív kvaterner szerkezet, vagyis egy teljesen biológiailag aktív forma képződik.
Sok esetben több enzimrészecske kombinálva kémiai reakciók sorozatát hajtja végre, és ezáltal felgyorsítja a folyamatot.
Előfordul, hogy több szövetben vannak enzimek, amelyek ugyanazt a reakciót katalizálják, de szerkezetileg nem hasonlítanak egymásra, izoenzimeknek nevezzük őket.
Az izoenzimek neve megegyezik, annak ellenére, hogy a hely és a szerkezet különbözik egymástól, de ezek a különbségek gyakorlati alkalmazásra alkalmasak. Ennek köszönhetően laboratóriumi vizsgálatokban csak azokat az enzimfrakciókat lehet meghatározni, amelyek egy adott szervből származnak.
Az enzimek működési mechanizmusai változatosak, de kémiai szempontból feladatuk mindig a reakció aktivációs energiájának csökkentése. Ez az az energiamennyiség, amellyel a szubsztrátoknak rendelkezniük kell a folyamat lejátszódásához.
Ez a hatás elérhető a reakció végrehajtásához megfelelő környezet megteremtésével, ugyanazon termékek előállításához különböző kémiai úton, vagy a szubsztrátok megfelelő térbeli elrendezésével.
E mechanizmusok mindegyikét felhasználhatják az enzimek.
Az enzimaktivitás szabályozása
Az enzimek hatása a környezeti paraméterektől függ: hőmérséklet, pH és mások. Mindegyik természetes katalizátornak megvan a maga optimális teljesítménye bizonyos körülmények között, amelyek nagyban eltérhetnek a környezeti feltételektől való toleranciától függően.
Hőmérséklet esetén a legtöbb enzimatikus reakció magasabb hőmérsékleten gyorsabb, de egy bizonyos hőmérsékleten a reakció hatékonysága hirtelen csökken, amelyet az enzim termikus károsodása (denaturáció) okoz.
Szerkezetüket tekintve a hormonok két csoportra oszthatók:
- egyszerű - ezek csak fehérjerészecskék
- komplex - amelyek nem fehérje csoport - kofaktor - kapcsolódását igénylik aktivitásukhoz
Ez utóbbiak kulcsszerepet játszanak az enzimek megfelelő aktivitásában és szabályozásában.
A kofaktorok viszont két csoportra oszthatók: azokra, amelyek az enzim működéséhez szükségesek, szorosan kapcsolódnak hozzá - ezek az úgynevezett protetikai csoportok, lehetnek fémek, szerves molekulák, például hem.
A második csoport koenzimek, általában felelősek a szubsztrátok vagy elektronok transzferéért, és az enzimhez való kötődésük gyenge, ebbe a csoportba tartozik például a folsav, az A. koenzim. Érdemes tudni, hogy sok vitamin működik kofaktorként.
Az inhibitorok teljesen más feladatot látnak el, olyan részecskék, amelyek az enzimhez kötődve gátolják az enzimatikus aktivitást.
Az inhibitorok több típusa létezik:
- irreverzibilis - a molekula állandó inaktiválódását okozza, és a reakció csak egy új enzim előállítása után mehet végbe
- versenyképes - ebben az esetben az inhibitor szerkezete hasonló a szubsztrátumhoz, ezért versenyeznek az aktív helyért. Ha inhibitor van kötve, a reakció sikertelen, amíg a szubsztrát normális
- nem versenyképes - az ilyen inhibitorok az enzimet nem a szubsztráthoz kötődő helyen kötik meg, így kapcsolódhat az enzimhez, de a reakció nem megy végbe
Az inhibitornál jóval magasabb szubsztrátkoncentráció esetén a kompetitív inhibitor hatása legyőzi, mert kinövi az aktív helyért folytatott "versenyt", nem kompetitív esetben a szubsztrát koncentrációjának növelésével nem lehet legyőzni a hatását.
Az aktivátor és az inhibitor rendszerek szabályozása mellett számos más módszer létezik az enzimaktivitás szabályozására.
Ezek a sejtek termelésének ellenőrzését érintik a fehérje képződés szintjén, valamint az úgynevezett poszttranszlációs folyamatok szabályozását, vagyis a fehérjemolekula szerkezetének változását, amely közvetlenül a riboszómában történő szintézise után következik be. Ezek a módosítások rövidítik például a polipeptidláncot.
A következő szabályozási módszerek az enzimek szegregációjára és elhelyezésére vonatkoznak a megfelelő területeken: sejtes és specifikus organellákban, vagy az extracelluláris rekeszben.
Van még egy fontos szabályozási mechanizmus - negatív visszacsatolás - ez az elsődleges kontrollrendszer az endokrin rendszerben. A gátlás elvén működik.
Ez azt jelenti, hogy ha egy enzim túl sok bizonyos hormont termel, akkor ahhoz kötődik, és ezzel gátolja az aktivitást és csökkenti a szintézist, így maga a reakciótermék is gátolja annak termelését.
Enzimek: Szerep
Az emberi test minden szövete meghatározott enzimkészletet termel, amely meghatározza e sejtek szerepét a test működésében. Hogy mik ezek az enzimek, azt a genetikai kód határozza meg, és hogy mely régiók aktívak az adott sejtben.
Az emberi testben bármikor több ezer kémiai reakció megy végbe, amelyek mindegyikéhez specifikus enzim szükséges, ezért nehéz lenne felsorolni ezeket a testünkben jelen lévő részecskéket.
Érdemes azonban ismerni néhányat a legjellemzőbbekről:
- Emésztőenzimek - az emésztőrendszer szövetei termelik, egyszerű vegyületekre bontják az ételt, mert csak ezek képesek felszívódni a vérbe. Ezek extracelluláris enzimek, ezért fő feladatukat a termelő sejteken kívül teljesítik. Ezen enzimek egy része inaktív formában, úgynevezett proenzimekként vagy zimogénekként képződik, és a gyomor-bél traktusban aktiválódik. Az emésztőenzimek közé tartozik például az amiláz, a lipáz, a tripszin.
- A miozin az izmokban található enzim, lebontja az ATP molekulákat, amelyek energiahordozók, ennek köszönhetően az izomrostok összehúzódását okozzák.
- A peroxidázok oxidáló enzimek és katalázok, azaz redukáló enzimek
- Az acetilkolinészteráz egy enzim, amely lebontja az acetilkolint, az idegrendszer egyik hírvivőjét
- A monoamin-oxidáz a májban legelterjedtebb enzim, amely felelős az adrenalin, a noradrenalin és egyes gyógyszerek lebontásáért
- A citokóm-oxidáz, egy nagyon fontos intracelluláris enzim, amely felelős az energiaváltozásokért
- A lizozim, a könnyekben vagy a nyálban jelen lévő anyag, amely védő funkciókat lát el, elpusztítja a kórokozókat
- Alkohol-dehidrogenáz, a máj enzimje, amely felelős az etanol lebontásáért
- Alkalikus foszfatáz, részt vesz az oszteoblasztok csontépítésében
Enzimek: Nómenklatúra
Az enzimnevek gyakran meglehetősen bonyolultak, mivel az általuk végrehajtott reakció nevéből és a reakcióban részt vevő szubsztrátból származnak, például 5-hidroxi-triptofán-dekarboxiláz.
Jellemzően az "-aza" utótagot adják a reakció általános nevéhez, és az enzimnév második részét az ebben a reakcióban részt vevő vegyület neve képezi.
Előfordul, hogy a név egyetlen, majd egy szubsztrátból származik, pl. Laktáz (enzim, amely lebontja a laktózt).
Ritkábban az enzimek neve egy általános folyamatból származik, amely részvételükkel megy végbe, például a DNS-giráz, a DNS-szálak forgatásáért felelős enzim.
Egyes enzimeknek végül is vannak közös nevei, vagy azok, amelyeket felfedezőik adnak, például a pepszin (amely lebontja az emésztőrendszerben lévő fehérjéket) vagy a lizozim (a könnyekben található baktericid enzim).
Van egy kis csoportja a restrikciós enzimeknek, amelyek felelősek a DNS-szálak vágásáért, ebben az esetben a név abból a mikroorganizmusból származik, amelyből az enzimet izolálták.
A Nemzetközi Biokémiai és Molekuláris Biológiai Unió bevezette az enzimek elnevezésének szabályait, és több osztályba sorolta őket a nómenklatúra egységesítése érdekében.
Nem váltotta fel a korábban leírt neveket, inkább kiegészíti őket, elsősorban a tudósok.
Az Európai Unió szabályai szerint az egyes enzimeket egy karaktersorozat írja le: EC x.xx.xx.xx - ahol az első számjegy az osztályt, a későbbi alosztályokat és alosztályokat, végül az enzimszámot jelenti. Az említett enzimosztályok a következők:
• 1 - oxidoreduktázok: katalizálják az oxidációs és redukciós reakciókat
• 2 - transzferázok: funkcionális csoportok (pl. Foszfát)
• 3 - hidrolázok: megfelelnek a kötések hidrolízisének (bomlásának)
• 4 - liázok: a kötéseket a hidrolízistől eltérő módon bontják meg
• 5 - izomerázok: felelősek a molekulák térbeli változásáért
• 6 - ligázok: kapcsolja össze a molekulákat kovalens kötésekkel
Enzimek és gyógyszer
Az enzimek óriási jelentőséggel bírnak az emberi egészség szempontjából. Megfelelő működésük lehetővé teszi az egészséges életet, és az analitikai eszközök fejlesztésének köszönhetően megtanultunk különböző betegségeket diagnosztizálni enzimmeghatározással. Mi több, képesek vagyunk sikeresen kezelni egyes enzimek hiányosságait és az ebből eredő betegségeket, de sajnos még mindig sok a tennivaló ebben az ügyben.
A metabolikus megbetegedések okainak kezelése jelenleg nem lehetséges, mert nem vagyunk képesek biztonságosan és hatékonyan módosítani a genetikai anyagot a sérült gének, és ezáltal a helytelenül előállított enzimek helyrehozására.
A diszfunkcionális enzimekből eredő betegségek
Testünk megfelelő működése nagymértékben függ az enzimek megfelelő működésétől. Sok esetben a betegség állapota befolyásolja az enzimek mennyiségét, emiatt túlzottan felszabadul a sejtekből, vagy éppen ellenkezőleg, hiányos.Az alábbiakban csak a rendellenes enzimatikus funkciók által okozott betegségek példái láthatók, ezek közül sokkal több van.
- Metabolikus blokkok vagy anyagcserebetegségek
Az anyagcsere-blokkok vagy az anyagcsere-betegségek az öröklődő betegségek csoportja, amelyet az anyagoknak a sejtekben történő felhalmozódása okoz az anyagcseréért felelős enzim hiánya miatt. Annyi szubsztrátum halmozódik fel az idő múlásával, hogy mérgezővé válnak a sejtekre és az egész szervezetre.
Több ezer ilyen betegség létezik, számuk tükrözi az emberi szervezetben található enzimek sokaságát, mivel a metabolikus betegségek befolyásolhatják az enzimeket kódoló legtöbb gént.
Ilyen például a galactosemia vagy a homocystinuria, amelyek ritka betegségek, amelyek leggyakrabban közvetlenül a születés után vagy az élet első éveiben jelentkeznek.
- Daganatok
A megbetegedések másik csoportja, amelyben enzimfunkciók működhetnek, a rák. Sok más funkció mellett az enzimek felelősek a sejtosztódás, az úgynevezett tirozin-kinázok szabályozásáért is. Ha ezek az enzimek kudarcot vallanak ezen a területen, akkor ellenőrizetlen sejtosztódás és ezért daganatos folyamat léphet fel.
- Tüdőtágulás
Kevésbé gyakori betegség az emfizéma, ebben az esetben az elasztáz túlaktívvá válik. Ez egy, a tüdőszövetben jelenlévő enzim, amely többek között a tüdőben található elasztin fehérje lebontásáért felelős.
Ha túl aktív, akkor megsemmisül az egyensúly a pusztulás és az építkezés között, hegesedés lép fel és emphysema alakul ki.
Enzimek: diagnosztikai felhasználás
A modern orvosi diagnosztika az enzimek meghatározásán alapul. Ez annak a ténynek köszönhető, hogy a betegség állapotai közvetlenül vagy közvetve az enzimek egyensúlyhiányához vezetnek, ami növeli vagy csökkenti mennyiségüket a vérben.
Ez nemcsak termelési rendellenességekből fakadhat, hanem például abból is, hogy nagy mennyiségű intracelluláris enzimet szabadít fel a vér vagy a vizelet a sejtmembránjának károsodása következtében.
A laboratóriumi vizsgálatokban használt enzimek például:
- Kreatin-kináz - az izmokban, a szívizomban is jelen lévő enzim, többszörös növekedése szívrohamra, szívizomgyulladásra, izombetegségekre - sérülésekre, dystrophiára utalhat.
- Laktát-dehidrogenáz - jelen van a test minden sejtében, különösen az agyban, a tüdőben, a fehérvérsejtekben és az izmokban. Nagy növekedése szívrohamokban, izom- és májbetegségekben vagy rákban figyelhető meg.
- Az alkáli-foszfatáz főleg a májban és a csontokban található meg, itt oszteoblasztok szabadítják fel. Ezeknek a szerveknek a betegségei okozhatják növekedését, de az alkalikus foszfatáz felesleg is jelezheti a csontok regenerációs folyamatát - műtét vagy törés után.
- A savas foszfatáz számos szervben - májban, vesében, csontokban, prosztatában - fordul elő, diagnosztikai szempontból növekedése csont- és prosztata betegségekre utalhat.
- Az aszpartát-aminotranszferáz és az alanin-aminotranszferáz - ezek a májra jellemző enzimek, amelyek szinte kizárólag hepatocitákban fordulnak elő, a májbetegségek alapszűrő diagnózisában alkalmazzák őket, értékeik többszörös növekedése pedig mindig a májbetegségek további diagnosztizálását ösztönzi.
- A glutamát-dehidrogenáz és a gammaglutamil-transzferáz - más májenzimek, az előbbiekhez hasonlóan, fontosak e szerv és az epeúti betegségek diagnosztizálásában.
- Az amiláz egy enzim, amely sok szervben jelen van, de a legnagyobb koncentrációt a hasnyálmirigy és a nyálmirigyek sejtjeiben érik el, diagnózisa a legnagyobb jelentőséggel bír betegségeikben.
- A lipáz egy másik hasnyálmirigy-enzim, specifikusságában különbözik az amiláztól, ami azt jelenti, hogy a lipáz csak a hasnyálmirigyben van jelen, és ennek az enzimnek a meghatározása során a normától való eltérés jelzi a hasnyálmirigy betegségét.
- A kolinészteráz egy enzim, amely lebontja az acetilkolint - az idegrendszer transzmitterét, ahol szintén a legnagyobb mennyiségben van jelen, a diagnosztikában foszfororganikus vegyületek mérgezésére használják.
- Koagulációs és fibrinolízis faktorok - ezek olyan anyagok, amelyeket a máj termel a véralvadásban, meghatározásaik nemcsak a folyamat értékelésében, hanem a máj működésének nyomon követésében is fontosak.
- Alfa-fetoprotein - májenzim, amelynek mennyisége növekszik ennek a szervnek a betegségei között, beleértve a rákot is.
- C-reaktív fehérje - a máj termeli, részt vesz az immunválaszban, mennyisége a vérben növekszik gyulladásos állapotokban - fertőzések, sérülések, autoimmun betegségek.
- Ceruloplasmin - egy másik májenzim, amelynek növekedése a Wilson-kórra jellemző.
- A piridinolin és a dezoxipiridinolin a csontreszorpció (roncsolás) markere, és az oszteoklasztok (oszteogén sejtek) működését jellemzik.
- A mioglobin - mint korábban említettük - az izmokra jellemző vegyület, így növekedése jelzi a csontváz vagy a szívizmok károsodását.
- A troponinok - az úgynevezett szívroham markerek - olyan enzimek, amelyek szabályozzák az izomrostok összehúzódását, különösen a szívizomban vannak. Károsodása nagy mennyiségű troponin felszabadulását eredményezi a vérben, amelyet a szívbetegségek diagnosztizálásához használnak. Érdemes azonban emlékezni arra, hogy a troponinek növekedése nemcsak szívrohamra utalhat, hanem elégtelenségére, szelephibáira vagy tüdőembóliájára is.
A fent felsorolt összes enzim több csoportba sorolható:
- Szekréciós enzimek - a norma alsó határa diagnosztikus. Ezek olyan enzimek, amelyeket fiziológiailag állítanak elő a szervek, de betegségek esetén csökken a számuk, például alvadási faktorok
- Indikátor enzimek - a növekedés fontos. Ez az enzimcsoport nagy számban jelenik meg a szervkárosodás és az enzimszivárgás miatt, ezek közé tartozik például a troponin
- kiválasztó enzimek - ezek olyan enzimek, amelyek normálisan a különféle szervek - a száj, a belek vagy a húgyúti - lumenébe kerülnek. Ha a kimenetük eltömődött, bejutnak a vérbe, például amilázba
Érdemes megjegyezni, hogy az enzimeket magában az orvosi diagnózisban használják. A biokémiai elemzéseket enzimek alkalmazásával végzik, és az enzimatikus reakciók eredményeinek megfelelő értelmezése lehetővé teszi a laboratóriumi vizsgálat eredményének megadását.
Enzimek és kezelés
Számos gyógyszer úgy hat, hogy befolyásolja az enzimek hatását, vagy hatására készteti őket, vagy éppen ellenkezőleg, gátlóként. Vannak enzimhelyettesítők, például hasnyálmirigy-elégtelenségben alkalmazott lipáz és amiláz tartalmú pankreatin.
Másrészt egyes gyógyszercsoportok gátolják az enzimek hatását, például angiotenzin-konvertáló enzim inhibitorok, amelyeket többek között hipertóniában és szívelégtelenségben használnak, vagy néhány antibiotikum, például amoxicillin, amely gátolja a bakteriális transzpeptidáz enzimet, amely megakadályozza a baktérium sejtfalának felépülését, és ezáltal gátolja fertőzés.
Néhány méreg az enzimek befolyásolásával is működik. A cianid a citokróm-oxidáz, a légzőszervi lánc elengedhetetlen alkotórészének erős inhibitora. Blokkolása megakadályozza a sejt energiához jutását, ami halálához vezet.
A sejtek életfolyamatainak megfelelő lefolyásához sok kémiai anyag jelenléte szükséges, amelyek szigorú arányban maradnak egymás között, és amelyek között folyamatosan zajlanak a kémiai reakciók.
Ezt a feladatot megfelelően működő enzimek látják el, amelyek szükségesek ahhoz, hogy szinte minden kémiai reakció az emberi test megfelelő működéséhez szükséges sebességgel és hatékonysággal történjen.
Az enzimek hatása sokszor, gyakran akár százszor is felgyorsítja ezeket a folyamatokat, ami fontos, maguk az enzimek sem kopnak el a lejátszódó reakciók során.
A katalizátorok hiánya vagy nem megfelelő működésük számos betegség megjelenését eredményezheti. Másrészt tevékenységük ügyes módosítása lehetővé teszi számos betegség sikeres kezelését.
Az enzimológia (az enzimek tudománya) rendkívül kiterjedt, és fejlesztése nemcsak a tudományos fejlődést hozhatja, hanem aktívan hozzájárulhat az orvostudomány fejlődéséhez nemcsak a kezelés, hanem a diagnosztika területén is.
A szerzőről

-w-laryngologii.jpg)








-czyci-zby-i-wzmacnia-cay-organizm.jpg)